引言
脊髓刺激(SCS)是一种用于治疗对药物无效的慢性神经病理性疼痛的外科技术。药物难治性神经病理性疼痛不仅可能导致长期残疾,还会显著增加医疗费用。SCS 系统由一个或多个植入硬膜外腔的电极组成,并与电源相连接,通常为植入式脉冲发生器(IPG)。在美国,SCS 的主要适应症包括“椎板切除综合症,表现为在一或多次脊柱手术后,背部和/或下肢持续性疼痛;另一个常见适应症为复杂区域性疼痛综合症(CRPS)。脊髓刺激的历史背景、适应症、手术技术、技术进展以及未来的发展方向都在上海高端医疗器械展上有所呈现。
脊髓刺激的历史和起源
电流自公元46年以来则被用于慢性疼痛的治疗。罗马医生斯克里博纽斯·拉尔古斯(Scribonius Largus)曾记录使用电鳗产生的电流治疗痛风和头痛。19世纪末至20世纪初的一些设备为现代经皮电神经刺激(TENS)装置奠定了原型。1965年,罗纳德·梅尔扎克(Ronald Melzack)和帕特里克·大卫·沃尔(Patrick David Wall)发表了他们开创性的“疼痛门控理论”。研究提出,激活有髓A-β纤维可以抑制较小且髓鞘较薄的A-δ纤维和无髓的C纤维(这些纤维负责疼痛的传导)。这一理论为传统SCS机制的理解与应用奠定了基础。
在“门控理论”发表两年后,帕特里克·沃尔(Patrick Wall)和神经外科医生威廉·斯威特(William Sweet)共同发表了一篇病例系列,报告了8名神经性疼痛患者通过电刺激治疗取得成功的案例。这些电刺激可以通过经皮方式(类似于经皮神经电刺激装置)施加,或通过皮下植入电极(如外周神经刺激器)进行,或者两者结合使用。不久后,诺曼·希利(Norman Shealy)也发表了一篇病例报告,介绍了髓背束刺激治疗(Dorsal Column Stimulation)用于治疗与支气管癌相关的顽固性疼痛。虽然患者在手术后不久因感染去世,但由于治疗前患者疼痛曾显著缓解,这种疗法迅速获得了广泛关注并逐渐流行开来。
随着我们对疼痛调节机制理解的不断深入,除了经典的门控理论外,SCS还通过多种其他机制发挥作用。其中一个重要机制是对下行抑制系统的调节,特别是去甲肾上腺素能和血清素能通路。去甲肾上腺素能通路的起始点是蓝斑核(locus coeruleus),该通路通过激活背角的肾上腺素受体,减少物质P的释放,同时增加GABA水平,从而抑制疼痛信号的传递。血清素能通路则起源于网状核(nucleus raphe magnus),其激活可以通过5-HT1A和5-HT7受体的激活来抑制疼痛,或通过5-HT2A和5-HT3受体的激活来引发疼痛。此外,内源性阿片系统的调节也有助于疼痛抑制,较大蛋白质的分解产物会生成类似阿片的物质,如β-内啡肽,从而减弱疼痛感知。最近的研究还发现,高频刺激和爆发模式可能通过其他机制发挥作用,例如直接减轻背角宽动态范围神经元的过度兴奋性,以及直接刺激小直径纤维,从而有效调节疼痛。
适应症
SCS系统经美国食品药物管理局(FDA)批准的适应症包括慢性顽固性下背痛、躯干和四肢的疼痛,特别是与失败性背部手术综合症相关的单侧或双侧疼痛、即使患者未曾接受脊柱手术的医学难治性下背痛和下肢疼痛、复杂区域性疼痛综合症(CRPS)I型和II型、糖尿病神经病变以及顽固的慢性神经性疼痛。引发神经性疼痛的疾病包括蛛网膜炎、术后疼痛、截肢后疼痛、退行性疾病及血管疾病相关的疼痛。当前的治疗建议指出,对于腰椎疾病患者,存在明显不稳定性或因脊柱外压迫引起的进行性神经功能缺失者,应排除在适应症之外。
在欧洲,SCS已被批准用于治疗难治性心绞痛和外周血管疾病相关的疼痛。一项大型随机对照试验(RCT)将SCS与冠状动脉旁路移植术(CABG)进行了比较,结果表明,两组患者在症状缓解方面的效果相当。近期的研究也显示了类似的治疗效果。
SCS用于治疗临床肢体缺血相关的疼痛显示出良好的临床前景。回顾性和前瞻性队列研究表明,当脊髓电刺激与常规医学治疗联合使用时,不仅能够显著缓解疼痛,还能促进创面愈合。随后的一项RCT也证实了SCS在缓解疼痛方面的积极作用。近期的研究成果进一步支持了这一治疗效果。
患者选择与结局预测因素
患者选择对SCS治疗的长期效果至关重要。关键在于识别那些主要患有神经病理性疼痛,并且在接受过药物、注射和物理治疗等适当保守治疗后仍未获得显著缓解的患者。
试验性植入是必要的,通常持续5-7天。在此期间,临时电极被植入目标区域的硬脊膜外,并通过小切口连接到外部脉冲发生器。患者可以反馈刺激效果、量化症状改善,从而帮助临床医生判断是否需要进行永久性植入。对于未能有效治疗或治疗不足的精神障碍及物质滥用,患者应进行正式的心理评估。抑郁症、焦虑症、物质滥用或创伤后应激障碍在多达65%的慢性疼痛患者中存在。通常,保险公司要求进行此类评估,尽管其价值曾一度受到质疑。近期数据显示,心理测试的预测价值取决于所评估的心理障碍类型及其结果。物质滥用、信心丧失以及未得到治疗的抑郁症与不良预后相关。心理测试有助于识别那些需要专科会诊、治疗或调整精神科药物的患者,从而优化术前筛选过程。
大多数临床研究和保险公司将疼痛减少50%(通过0-100的视觉模拟量表或0-10的数字评定量表)视为试验成功的标准。患者应被鼓励进行通常会引发疼痛的活动,以便更准确地评估刺激系统的效果。然而,由于试验期有限,且无法尝试多种不同的波形,可能存在回归均值的现象,这使得判断试验是否成功变得更为复杂,特别是在没有明显感觉异常的刺激模式下。因此,除了疼痛缓解外,减少阿片类止痛药的使用、改善睡眠质量和提高功能等因素也是重要的评估标准。
鉴于试验本身并非完美,部分学者主张在没有试验的情况下直接进行永久性植入。最近的一项英国研究表明,进行试验并未带来临床或经济上的显著益处。对于采用外部电源而非植入式脉冲发生器(IPG)的系统来说,试验显得不必要,因为这不仅增加了患者的时间负担和感染风险,还导致保险公司承担双重费用。
关于选择进行SCS治疗还是重复脊柱手术的问题,尽管已有数据支持SCS治疗,但这一问题依然存在争议。2005年,North等人开展了一项前瞻性随机研究,将那些在腰椎手术后出现根性症状并被认为适合接受重复脊柱减压手术(包括或不包括固定)的患者随机分为两组,一组接受重复脊柱手术,另一组接受SCS治疗。这些患者中排除了有进展性神经功能缺损和明显脊柱不稳定的情况。研究结果表明,SCS比重复脊柱手术更为安全,能够显著减少阿片类药物的使用,缓解疼痛,并且患者转向重复脊柱手术的比例较低。该研究使用了常规的脊髓刺激方式。许多脊柱外科医生认为这项研究规模较小,仅在单中心进行,而且自研究开展近20年以来,外科技术已有了显著进展。而SCS的支持者则认为,SCS技术自研究开展以来也有了显著的进步,特别是在电极和波形的设计上。此外,与传统脊柱手术不同,SCS可以先进行试验性植入,评估效果后再决定是否进行长期植入,这一点是脊柱手术所无法提供的。
手术禁忌症包括出血倾向、糖尿病控制不佳(HbA1C > 10)、吸烟或饮酒、活动性感染以及认知障碍。术前咨询和期望管理至关重要,患者需明确认识到,虽然无法完全消除疼痛,但通过手术可以有效减轻疼痛并改善功能。治疗成功的影响因素包括疼痛的病因(术后或创伤后疼痛患者预后较差)、诊断明确、预防术后跌倒以及使用高频刺激技术的设备。
SCS的外科植入
在成功完成试验后,准备进行永久植入时,需要考虑多个因素。包括选择经皮或鳍状电极进行植入、确定最佳波形,以及决定植入方式(清醒状态下进行术中测试或麻醉状态下进行术中神经监测)。这些都应与患者充分讨论。在全身麻醉下进行电极植入时,则不建议不进行电生理监测。
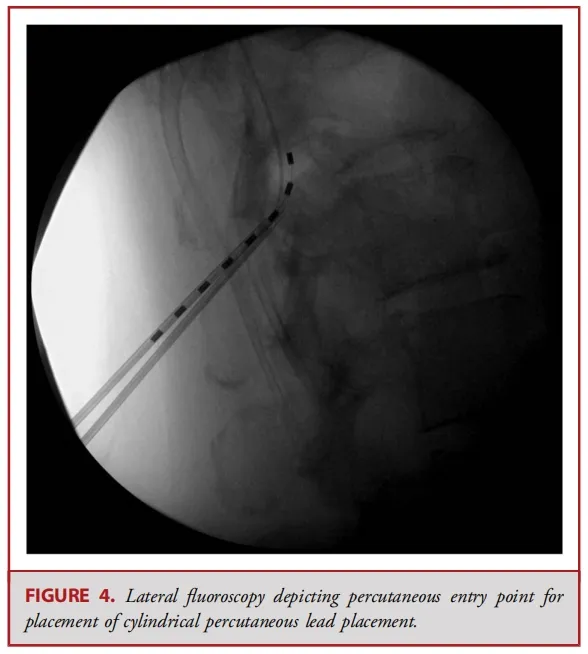
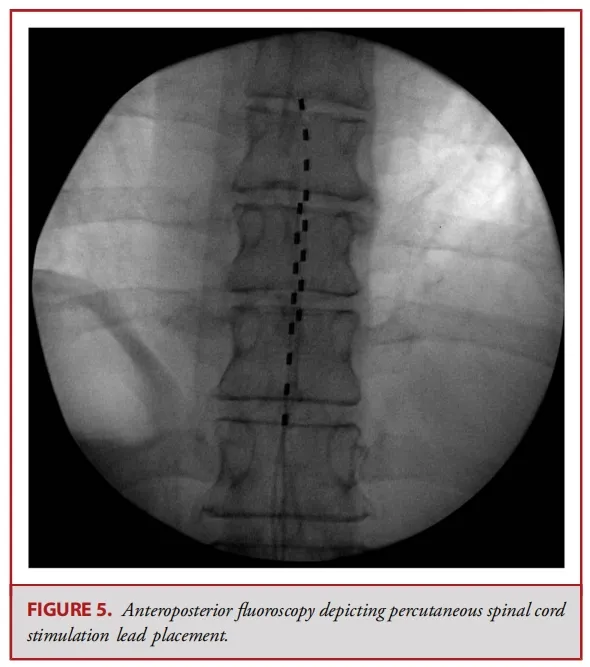
经皮电极通常由 8 个球形接触点组成,而鳍状电极则通常具有16至20个接触点,且所有接触点都平铺在硬膜表面(见图 1-3)。经皮电极通常通过改良版的 Tuohy 导管进行插入(见图 4)。在使用失去阻力法进入硬膜外腔后,电极在透视引导下被推进至与疼痛部位相应的脊髓节段(见图 5)。经皮电极和鳍状电极在镇痛效果上具有相似的疗效。经皮电极植入属于较低侵入性的手术,术后并发症的发生率较低(2.2%,相较于鳍状电极3.4%),因此对于合并症较多的患者来说,是一种更为理想的选择。鳍状电极虽然更具侵入性,但与圆柱形经皮电极相比,电极移位的发生频率较低。由于鳍状电极具有更多接触点,因此可以实现更为精准和高效的刺激。
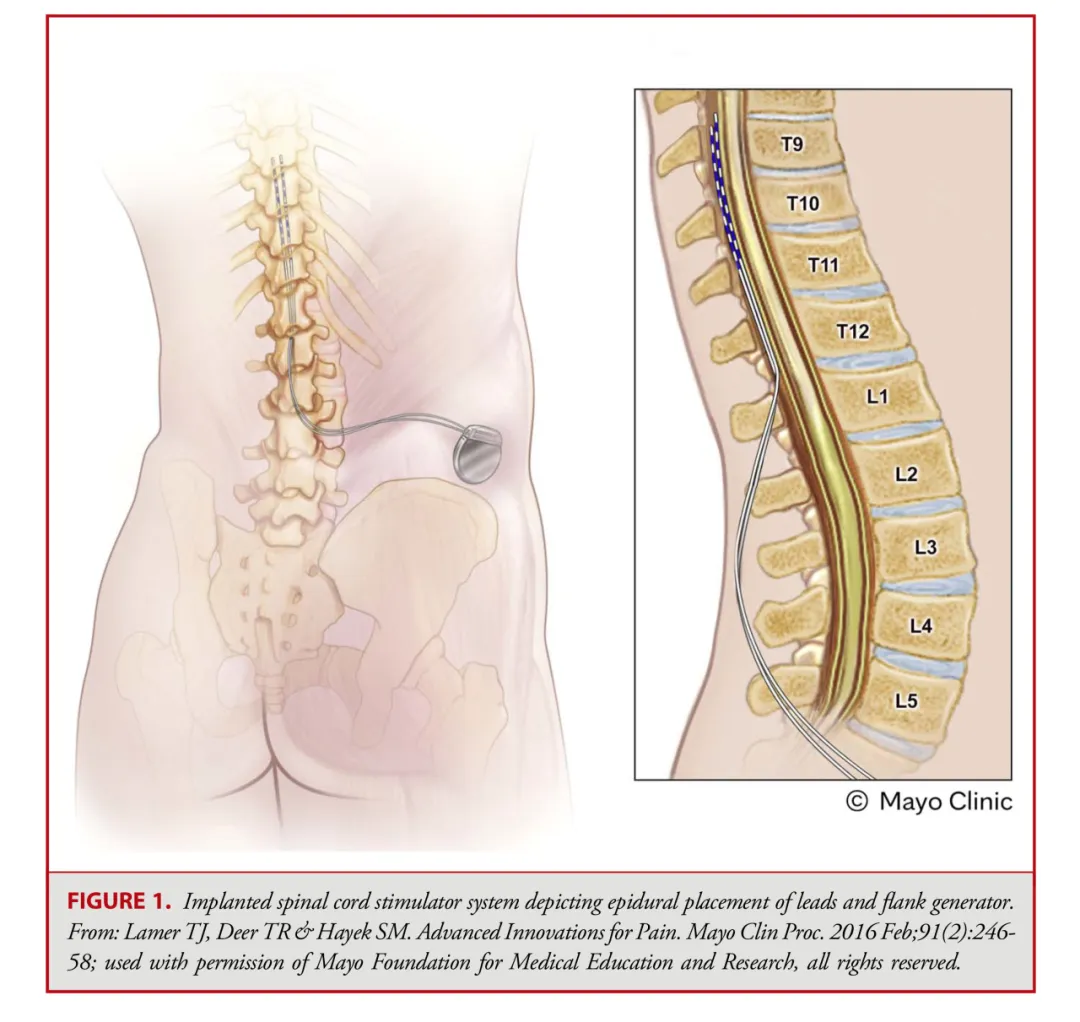
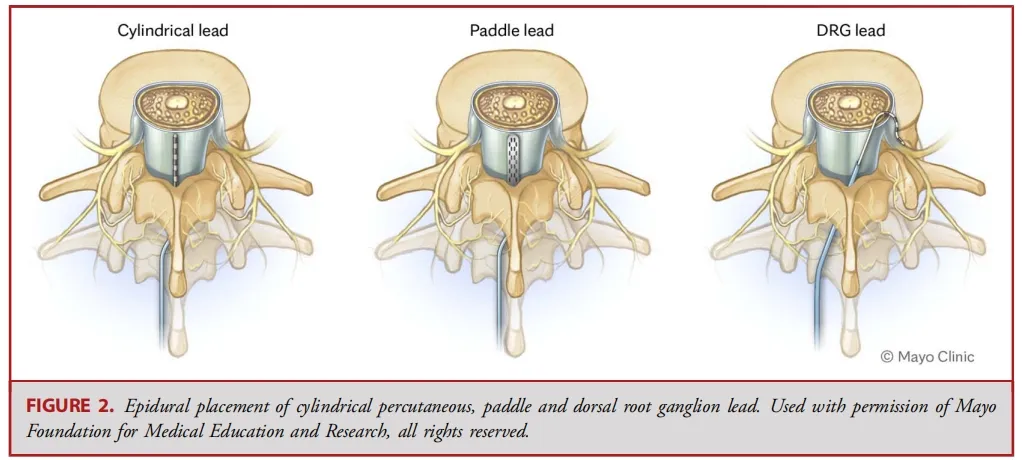
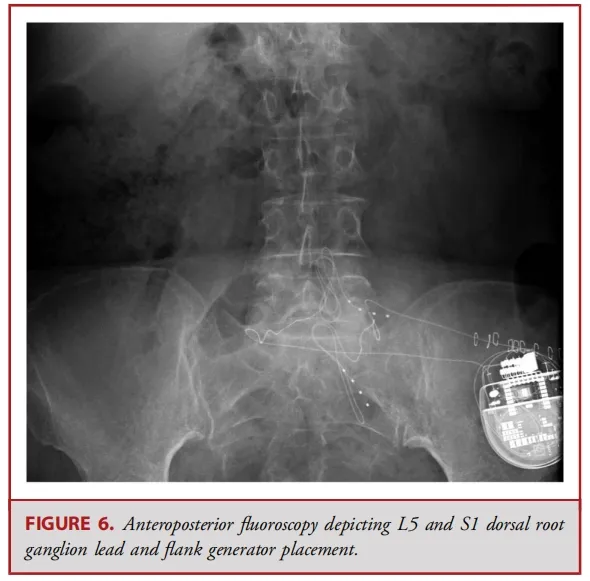
背根神经节(DRG)刺激器导线的置入传统上可通过对侧的旁中线途径。此时,Tuohy针穿刺点位于椎体旁,距离目标椎孔约2个椎体水平。使用失去阻力法将针头推进至接近中线的尾端椎板间隙。一旦进入硬膜外腔,导管鞘会被调整方向,使其指向目标椎孔,并缓慢推进。接着插入导丝,然后插入导线;使用透视法确认导线位置。最后,在硬膜外腔内形成一个应变缓解的“S”形环,并将导线固定在深筋膜上(见图 2、6 和 7)。

当手术在患者清醒状态下进行时,通过外部脉冲发生器激活导线,产生感觉异常(paresthesia)。患者根据刺激的位置和强度进行反馈,以确保诱发的感觉异常与患者的疼痛区域完全重合。若手术在患者麻醉状态下进行,并结合术中监测,如肌电图和/或体感诱发电位,只要在试验过程中已确定正确的头尾方向水平,麻醉状态下的植入方式与清醒状态下的植入效果是等效的。肌电图激活和体感诱发电位碰撞是两种常用方法,用于确定电极在背柱中的侧向位置,并监测神经是否受损。
颈段脊髓硬膜外刺激
关于胸段SCS治疗的成功是否能够延伸至颈段SCS,这一问题仍存在争议。颈段SCS已被用于治疗类似的适应症,如复杂性区域疼痛综合症(CRPS)、臂丛神经撕脱、颈神经根病、颈部疼痛和神经性疼痛。来自一项前瞻性、多中心、国际注册研究数据表明,评估颈段SCS治疗各种适应症时,大多数患者的疼痛缓解超过50%,且大多数患者在各个评估时间点均认为疼痛缓解效果良好或非常好。此外,患者普遍报告情绪、满意度和生活质量有所改善或显著改善。最近的一项前瞻性临床试验证据进一步确认了颈段SCS在缓解颈部和上肢疼痛方面的安全性和有效性。
并发症
根据Cameron等人的研究,导线移位率13.2%,导线断裂率9.1%,感染率3.4%,植入部位疼痛发生率0.9%,硬膜穿通发生率0.3%。相比于鞘管导线,经皮导线的移位率和感染率更高。大多数感染发生在设备植入后的90天内。SCS移除率在90天和1年时分别为0.3%和3.4%。对超过12,000名Medicare患者的回顾性研究表明,15.5%的患者在刺激器植入后3年内接受了后续的脊柱减压或融合手术。
刺激波形进展
随着技术的进步,不断衍生出了新的多种波形,包括差分复用波形、爆发波形和高频波形。传统的SCS疗法通过低频(<200 Hz)、低强度(0.5-5 mA)和短脉冲宽度(30-90微秒)的持续刺激传递电流,以在疼痛区域产生麻木感。近年来,10 kHz高频(HF)和爆发波形的SCS采用了不同于前述持续刺激的频率和强度,也能够实现无麻木感的刺激。
一项大型多中心随机对照试验显示,与传统SCS相比,使用10 kHz高频(HF)治疗慢性背痛和腿痛在长期疗效上具有显著优势,反应率分别为76%与50%。目前,HF 10的批准适应症已扩展至未曾进行过脊柱手术的下背痛患者。研究认为,高频刺激能够优先阻断传递振动感觉的较大直径纤维,这些纤维与麻木感相关,同时刺激中等直径纤维,从而实现疼痛缓解。最近,高频刺激在糖尿病神经病变引起的疼痛治疗中也取得了显著成效,研究显示,平均疼痛缓解率为74.3%,且85%的患者在1年后被评定为有效反应者。
De Ridder及其同事发布的临床研究提供了一种新的刺激模式,该模式模拟了丘脑中测得的调节性活动。这种爆发性刺激模式每秒产生高达40次、频率为500 Hz的间歇性电脉冲。SUNBURST试验将爆发性SCS与传统脊髓刺激SCS进行了对比。结果表明,爆发性刺激和持续性刺激在疼痛缓解效果上相似,但患者对爆发性刺激的偏好明显高于持续性刺激。
差异化靶向多路复用(DTM)方法通过多种电脉冲信号调节神经元和神经胶质细胞,刺激参数如频率、脉冲宽度、电荷平衡和幅度可以根据不同刺激需求进行调整。在腰背痛和腿部疼痛的患者中,DTM-SCS的反应率为80.1%,显著高于传统脊髓刺激的51.2%,且这种反应在6个月和12个月后得到了持续。在爆发性刺激与10 kHz SCS对术后残留性背痛综合症(FBSS)患者的效果比较中,Muhammad等人报告称,1年后爆发性刺激能够提供更多的疼痛缓解率。另一项研究显示,采用多种波形、不同场形以及多个独立电流控制参数的个性化治疗,能够有效缓解那些对10 kHz刺激反应不佳的慢性腰背痛和腿部疼痛患者的症状。目前,针对传统SCS、爆发性和高频SCS在FBSS中的疗效研究仍在进行中。
除了尝试不同的波形外,研究还开始关注评估背侧柱以外的其他靶点。在ACCURATE研究中,研究人员将脊髓后根神经节刺激与传统的诱发感觉的SCS方案进行了比较,用于治疗下肢复杂区域疼痛综合症(CRPS)类型1和类型2。结果显示,与传统SCS相比,脊髓后根神经节刺激能够显著提高疼痛缓解效果,患者的疼痛缓解率分别为81.2%和55%。
成本效益
成本效益分析应考虑与治疗相关的直接费用以及因生活质量改善而带来的间接收益。尽管SCS初期费用较高,但多项研究表明,与单纯依赖持续医学管理相比,SCS从长期来看具有显著的成本效益。研究显示,SCS与术后背痛综合症(FBSS)的再手术相比,其费用分别为48,357美元和105,928美元。此外,一项评估SCS和外周神经刺激成本效益的综述研究发现,与神经调节前的医疗费用相比,植入后的3年内节省了93,685美元。在复杂区域疼痛综合症(CRPS)患者群体中,尽管初期植入的费用较高,但在患者一生的治疗过程中,平均节省了60,000美元。类似的,商业保险、医疗补助(Medicaid)和联邦医疗保险(Medicare)患者群体在SCS植入后长达9年的时间里,也实现了显著的成本节省。
减少阿片类药物的使用
根据最近一项IBM数据库调查,SCS植入后一年,60.4%的患者在一定程度上减少了阿片类药物的使用,其中17%的患者完全戒除了阿片类药物。完全戒除阿片类药物的比例与术前阿片类药物使用量的减少密切相关。长期使用阿片类药物、同时使用其他止痛药物以及肥胖等因素,会降低患者在SCS治疗后完全戒除阿片类药物的可能性。
SCS的未来
闭环SCS
目前市面上所有的SCS系统均为开环系统,提供固定的幅度、频率和脉冲宽度,向脊髓背侧柱传递恒定的输出。一家制造商的植入式脊髓刺激发生器(IPG)配备了加速度计,可在患者躺下时自动调整刺激幅度。一种新型的SCS系统通过实时监测诱发复合动作电位的电生理活动来调节输出,已被证明能够激活脊髓更广泛、带来更显著的疼痛缓解(65%的患者整体疼痛缓解达到80%)以及改善生活质量。与传统的开环SCS技术相比,闭环SCS系统在效果上更为优越。该系统近期已在美国获批,用于治疗慢性、顽固性躯干和/或下肢疼痛。
其他适应症
SCS为神经调节提供了直接作用于中枢神经系统的途径。尽管过去55年间,SCS主要应用于疼痛管理,但其潜在应用远不止于此。SCS能够部分恢复脊髓损伤患者的运动和自主功能,特别是对于那些损伤多年且在损伤部位仅残留极少脊髓组织的患者。最近的一项研究显示,在发生中风超过三年的2名患者中,通过植入颈脊髓刺激器,成功改善了肌力、运动和功能性动作,推测这一改善可能是通过增强残余的皮质脊髓束功能实现的。此外,2021年对ClinicalTrials.gov上注册的临床试验进行回顾发现,已有针对SCS治疗重度抑郁症、高血压、意识水平下降和帕金森病步态障碍相关的研究。更近期的研究表明,将脊髓刺激与大脑—脊髓接口结合使用,使一名四肢瘫痪患者重新获得了步态控制相关肌肉的自适应调节能力。
结论
充分证据表明,SCS疗法在治疗失败性背部手术综合症(FBSS)、复杂性区域疼痛综合症(CRPS)以及包括糖尿病神经病变在内的神经病理性疼痛方面具有显著疗效。未来的研究应继续探索SCS在其他适应症中的应用。在评估患者是否适合治疗时,心理筛查至关重要。此外,诸如考虑导线位置、导线类型、监测方式、手术辅助手段和波形编程等因素,能够帮助提供以患者为中心的个性化治疗方案。未来,闭环刺激技术的发展以及生理生物标志物的应用,将有助于进一步提高疗效与扩大受益人群。
文章来源: Huashan NICU
若涉及侵权,请立刻联系删除
关键字:








